| 氧化反应汇总 | 您所在的位置:网站首页 › corey kim氧化反应 › 氧化反应汇总 |
氧化反应汇总
|
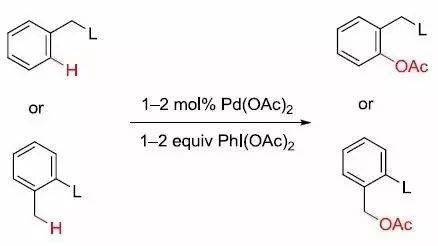
八、Sanford反应 在钯催化下通过导向基团(如吡啶和嘧啶)进行C-H位乙酰氧基化得反应.
九、Trost氧化 一级,二级醇共存的情况下,选择性氧化二级醇的反应。 十、亲核环氧化反应 缺电子的烯烃,在碱性条件下,被双氧水与过氧化叔丁醇环氧化的反应。由于该反应是亲核反应,所以底物中没有吸电子基团的话,环氧化无法进行。 十一、Kornblum氧化
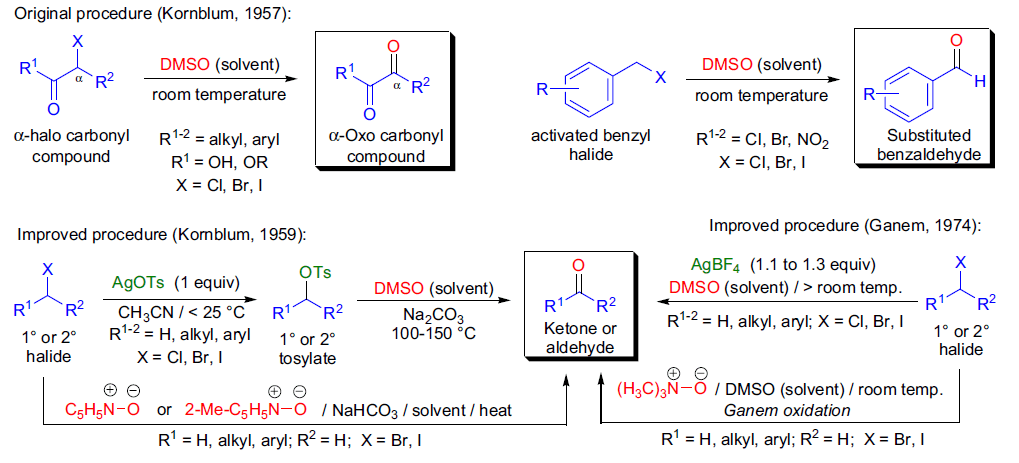
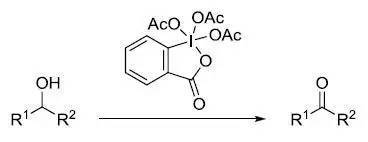
1957年,N. Kornblum及其团队发现将高活性的苄溴和α-溴代 芳基酮等底物溶于DMSO中可以被氧化为相应的醛和苯基二羰基化合物。此方法的缺点是:苯环上没有吸电子基团的苄溴产率很低,而非活性的卤代物,如脂肪烷基卤代烷不发生反应。很快他们发现,将低活性的卤代烷转化为活性更高的对甲苯磺酸酯,在碱(如碳酸钠)存在的热的DMSO中能迅速发生氧化。利用DMSO作为氧化剂将卤代烷氧化为相应的羰基化合物的反应被称为 Kornblum氧化。 十二、Mukaiyama氧化反应 此方法利用 S -苯基硫代羟胺胺,是最新型的氧化反应中的一种。 试剂在室温下也容易处理,并且反应条件很温和(室温,弱碱性)的氧化反应。 十三、Brown硼氢化氧化反应 硼烷对烯烃进行协同顺式加成得到有机硼加成产物,然后在碱性条件下氧化得到醇的反应。 十四、 Dess-Martin高碘烷氧化 利用三乙酰氧基高碘烷将醇氧化为相应的羰基化合物的反应。
常用氧化剂----DMP 十五、Saegusa氧化反应
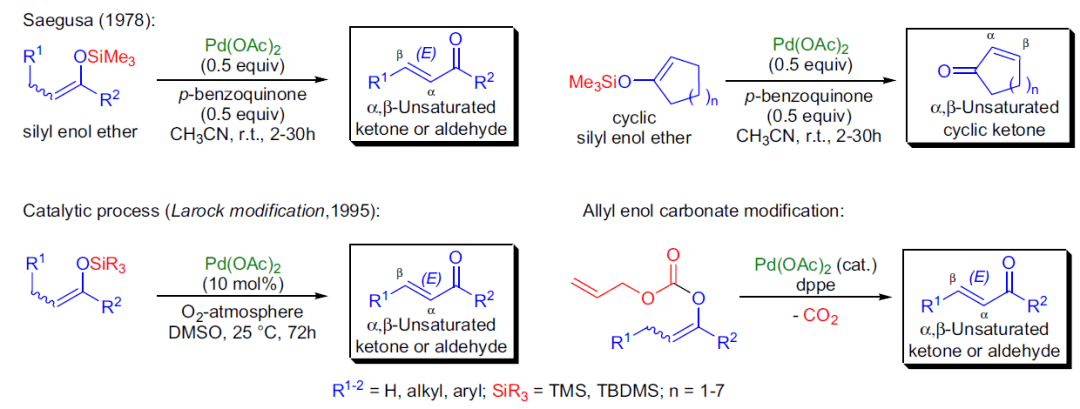
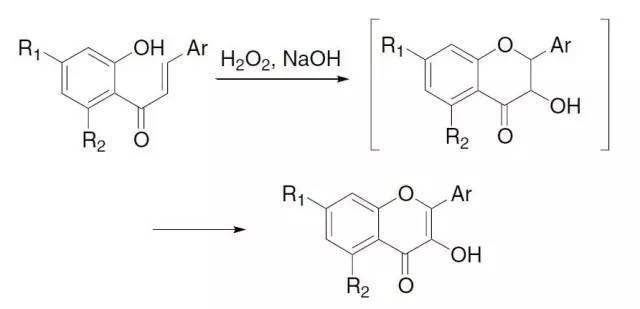
1978年,T. Saegusa课题组报道了在乙腈中硅基烯醇醚和亚化学计量的Pd(OAc)2和对苯醌室温下反应得到相应的α,β-羰基化合物。酮转化为相应的烯醇基硅烷,在钯催化下将其区域选择性氧化为α,β-不饱和酮的反应被称为Saegusa氧化反应。 十六、 Algar-Flynn-Oyamada氧化反应 在碱和双氧水存在下,将 2’-羟基查尔酮(2’-hydroxychalcones)转化为 2-芳基-3-羟基- 4H -1苯并呋喃-4- 酮(黄酮醇, flavonols)。
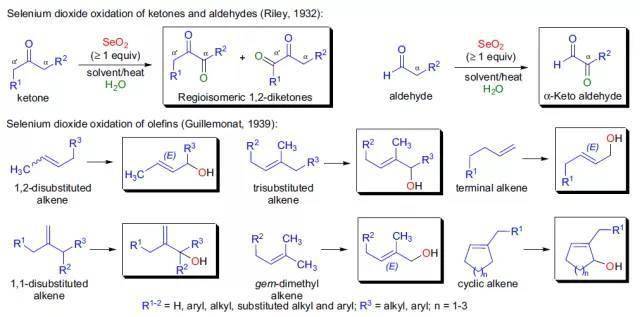
十七、 Riley氧化 使用二氧化硒氧化羰基α位亚甲基或烯烃的烯丙位的反应都被称为Riley氧化反应。
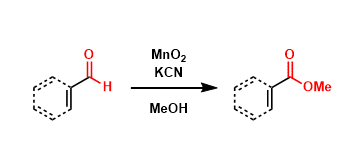
常见氧化剂----二氧化硒 十八、Prilezhaev反应 烯烃被过氧酸环氧化得到环氧乙烷的反应。应用最广的氧化剂是 mCPBA ,另外二甲基过氧化酮和过氧乙酸也经常被用于此反应。 十九、Rubottom氧化反应 烯醇基硅烷用mCPBA氧化,水解得到α -羟基化产物的反应。 二十、Corey-Gilman-Ganem氧化反应 利用二氧化锰与氰离子体系在温和条件下选择性氧化α,β-不饱和醛到对应羧酸酯的手法。
二十一、Corey-Kim氧化反应 醇在N-氯代丁二酰亚胺(NCS)和二甲硫醚(Me2S,DMS)的作用下,再经碱处理可得相应的醛酮的反应。 二十二、过氧化酮氧化(Oxidation with Dioxirane) 丙酮与Oxone反应配制的甲基二环氧乙烷(DMDO),可以用于烯烃的环氧化反应。另一种过氧化酮甲基三氟甲基二环氧乙烷(TFDO)的反应性是DMDO的600倍。 常用氧化剂----DDO 常用氧化剂----TFDO 二十三、活性二氧化锰氧化 活性MnO2广泛用于氧化α,β-不饱和基团(三键,双键、芳香环)的醇,可选择性氧化烯丙式醇,条件温和,不会引起双键的异构化MnO2的活性及溶剂的选择对反应至关重要,常用的溶剂有二氯甲烷、乙醚、石油醚、己烷、丙酮等。 二十四、 Moffatt氧化反应 通过DCC和DMSO氧化醇得到醛酮的反应,也被称为Pfitzner-Moffatt氧化。 二十五、硅烷氧化制备醇 常见的就这两类反应: (Fleming-) Tamao (-Kumada)氧化反应 Fleming (-Tamao) 氧化反应 这两类氧化反应的方法基本上都是由 Fleming和 Tamao发现的。对于二甲基苯基硅基的氧化,涉及的特殊机理,最初是由Fleming进行研究的。 二十六、 Pinnick氧化
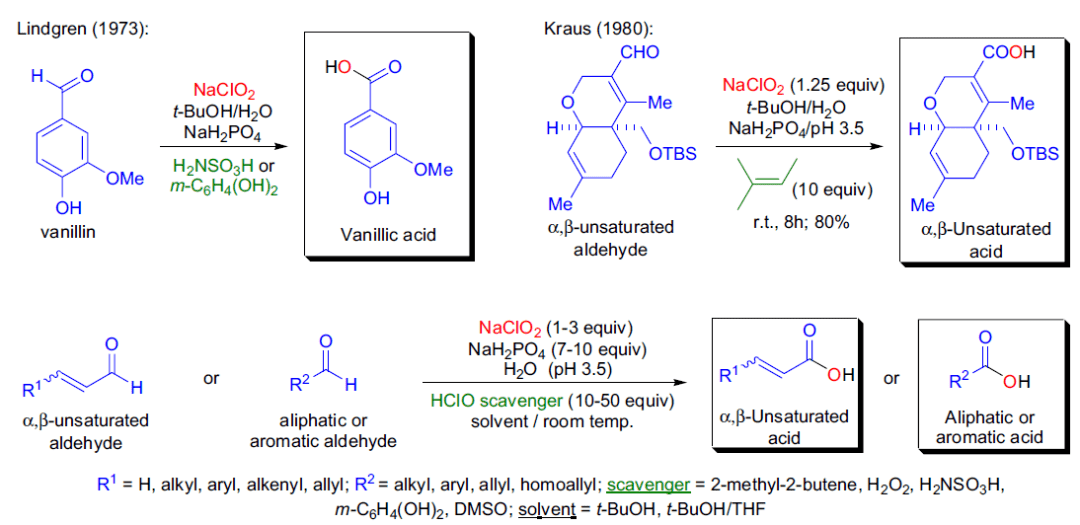
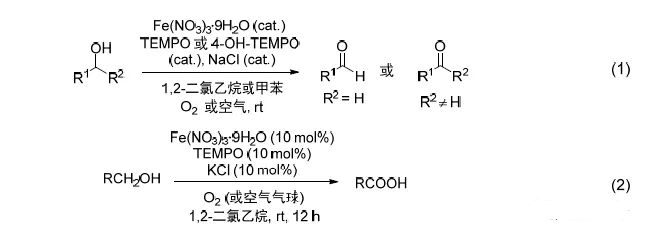
在1973年,B.O.Lindgren 第一次利用廉价的亚氯酸钠和次氯酸反应助剂(如氨基磺酸,间苯二酚)在温和的条件下将香草醛氧化为相应的香草酸。次氯酸是此氧化反应的副产物,它能够和亚氯酸钠反应生成生成ClO2或与C=C键反应。几年后,G.A.Kraus第一次使用2-甲基-2-丁烯作为助剂在缓冲液条件下氧化脂肪和α,β-不饱和醛。在1981年,H.W.Pinnick 报道了NaClO2/2-甲基-2-丁烯体系可以广泛应用于氧化α,β-不饱和醛而不影响双键。 利用NaClO2/2-甲基-2-丁烯体系将醛(脂肪醛,芳香醛,不饱和醛)氧化为羧酸的反应被称为Pinnick氧化反应。 二十七、 Griesbaum共臭氧化反应 Griesbaum共臭氧反应可以通过O -甲基肟和羰基化合物在臭氧中反应得到特定的四取代臭氧化物(1,2,4-三氧五环化合物)。 二十八、Criegee臭氧化反应 臭氧先对烯烃进行1,3-偶极环加成得到初级臭氧化物,重排得到 两性离子过氧化物,再一次1,3-偶极环加成生成最终的臭氧化物。 二十九、四氧化锇氧化 , Upjohn双羟化反应机理图 在催化量的四氧化锇和共氧化剂的存在下,烯烃被氧化成邻二醇。通过其他的试剂较难实现的烯烃转化成邻二醇通过此方法能很温和平稳的进行。尽管锇价格相对昂贵,也被频繁使用。 常用氧化剂----四氧化锇-铁氰化钾 常用氧化剂----OsO4/NMO 三十、亚硝酸钠和醋酐氧化示例 一个较实用的合成醛的方法,反应一般在室温下进行,反应时间较短,可氧化大部分伯醇、烯丙醇和苄醇,而且产率较高,副反应较少。一般仲醇很难反应,可能会生成亚硝酸酯。 三十一、Elbs氧化 此反应也被称为Elbs过硫酸盐氧化,此反应与Boyland–Sims类似只是底物由苯胺变为苯酚,机理也与其类似。 三十二、Boyland–Sims氧化 碱性条件下利用过硫酸钾氧化苯胺在邻位引入酚羟基的反应。通常氧化优先发生在氨基的邻位得到邻羟基产物。苯酚类底物在相同条件下被氧化的反应被称为Elbs过硫酸盐氧化反应(Elbs persulfate oxidation)。 三十三、 Oppenauer氧化 烷氧基金属盐催化剂催化下将二级醇氧化为酮的反应。 三十四、氧化反应之醇氧化为醛酮( 汇总类 ) Sarett-Collins氧化(Sarett-Collins Oxidation) 常见的几种活化DMSO氧化醇制备醛酮的方法 (汇总类) 三十五、Wacker氧化反应 氯化钯和氯化铜催化下烯烃氧化得到酮的反应,少数情况下可以氧化为醛。 三十六、Dakin氧化反应 碱性条件下芳基醛酮通过过氧化氢氧化得到酚的反应。反应中先形成芳基甲酸或链状烷烃酸中间体进而皂化得到酚。反应机理同Baeyer–Villiger氧化类似。邻位和对位的给电子取代基 (NH2, OH)对反应有利。 三十七、Kennedy氧化环化反应 1992年Kennedy, R. M. 等人报道了5-羟基烯烃和氧化铼(VII) (Re 2 O 7 )反应得到2-羟甲基四氢呋喃的反应。 三十八、 Baeyer–Villiger氧化 过氧化物氧化醛酮得到酯的反应。 三十九、TEMPO氧化 TEMPO = 四甲基六氢吡啶氧化物。2,2,6,6-四甲基哌啶氧自由基是一种很稳定的氮氧自由基,在此氧化反应中充当催化剂。 TEMPO氧化醇到醛酮 Anelli在1987年报道了在二氯甲烷-水两相溶剂中利用TEMPO( ca. 1% mol), NaOCl,KBr 和NaHCO3将醇氧化为醛酮的反应。 TEMPO = 四甲基哌啶氧化物。2,2,6,6-四甲基哌啶氧自由基是一种市售的很稳定的氮氧自由基化合物,在此反应中充当催化剂。 反应中加入碳酸氢钠的作用是保持体系中的pH 在 8.6–9.5 ,因为市售的次氯酸钠的pH=12.7,碱性太强影响反应进行,当反应底物对碱敏感时可以用0.1 M HCl调节pH到6.5-7.5。 反应中加入KBr的作用可能是会产生一些HOBr,加速反应。反应一般在0℃到室温反应,反应速度很快(氧化到醛一般3min,氧化为酮7-10min)。 仲醇氧化到酮就会停止,但醛可能会继续氧化生成羧酸,但反应速度很慢,另外必须加入过量的次氯酸钠才可以继续氧化。 麻生明氧化反应 【化学经纬】
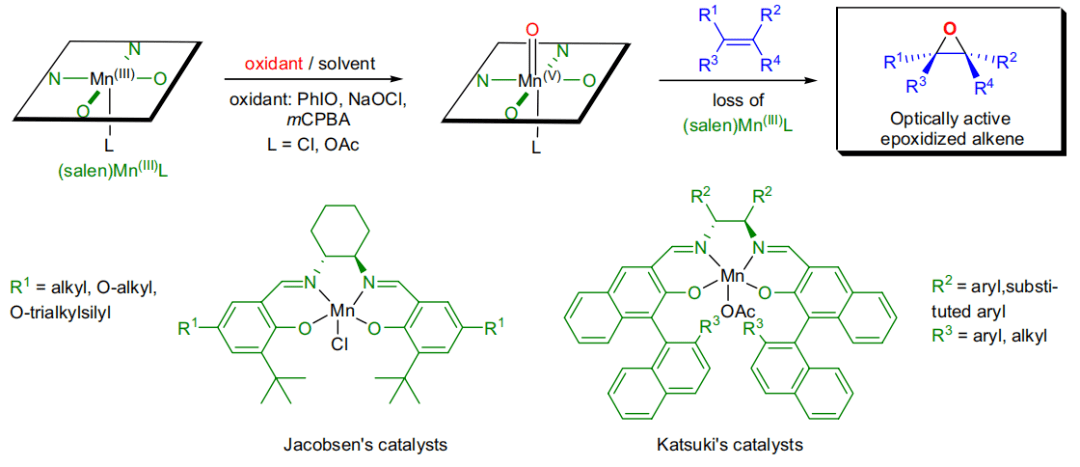
麻生明氧化指以氧气(空气)为氧化剂,九水合硝酸铁、2,2,6,6-四甲基氮氧化合(TEMPO) 及其衍生物、氯化钠或氯化钾为催化剂,在室温下把伯醇氧化为醛或羧酸、把仲醇氧化为酮的反应。 四十、 Jacobsen–Katsuki环氧化反应
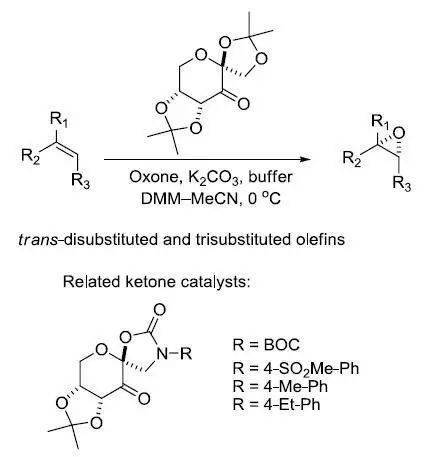
利用Mn(III)salen催化剂催化下氧化(Z)烯烃不对称合成环氧化物的反应。 常用催化剂----(R,R)-Jacobsen 催化剂 四十一、史氏不对称环氧化反应 反式二取代的烯烃或三取代的烯烃在果糖衍生的手性酮催化下利用Oxone作为氧化剂进行不对称环氧化的反应。此反应的一大特点就是利用了有机催化剂。
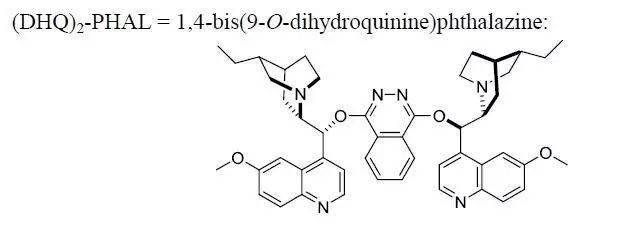
四十二、 Fétizon氧化剂 Fétizon氧化剂,以Celite为载体的碳酸银(I),该试剂是一种十分温和的氧化试剂,适用于对酸和碱都敏感的化合物的氧化,1968年由Marcel Fétizon首先发现。 可以氧化伯醇和仲醇,特别是可以选择性的把半缩醛氧化成内酯,效果十分好。而该氧化反应也被称为Fétizon氧化。反应体系中的极性基团和醇的α-H附近的大位阻基团对反应活性有很大的抑制作用。反应一般在非极性溶剂中进行,反应完毕后,直接过滤就可除去氧化剂。 常用氧化剂----Ag2CO3/Celite 四十三、Sharpless不对称双羟基化反应 RL:最大取代基,RM中等取代基,Rs:最小取代基。
含有(DHQ)2-PHAL的催化剂为ADmix-α (DHQD)2-PHAL
含有(DHQD)2-PHAL的催化剂为ADmix-β 锇催化剂和金鸡纳碱衍生物催化下烯烃对映选择性顺式双羟基化反应。 Sharpless不对称羟胺化 四十四、PCC(Pyrindium Chlorochromate)氧化 PCC可以将伯醇和仲醇氧化成醛和酮。由于在有机溶剂中反应,一般不会将醇氧化到羧酸。但当反应体系中有水时,生成的醛酮会形成水合醛或水合酮,进而继续氧化得到羧酸。因此反应体系中要求无水。 PCC中所用的碱除吡啶外,也可以是其它碱,且随着碱性部分碱性的增强,氧化的选择性也提高。其中, DMAP·HCrO 3 Cl 为适用于烯丙醇类及苄醇类的选择性氧化试剂。 常用氧化剂----PCC 四十五、PDC(pyridinium dichromate)氧化 PDC是一种广泛应用的温和型中性氧化剂。与PCC 比较,氧化能力较弱,没有酸性。与MnO2 比较,氧化能力较强,制备方便。PDC 的氧化能力和反应溶剂有关, PDC用DMF当溶剂可以将伯醇氧化为酸, 而在 CH2Cl2 中则将伯醇、仲醇、苄醇和烯丙基醇稳定地转变为相应的醛酮化合物。通过选用不同的溶剂,PDC 许多时候可以取代 PCC 和 MnO2 在有机合成中的许多功能。另外PDC还可 将环状半缩醛氧化成为相应的内酯或者内酰胺,在 叔丁基过氧化氢帮助下将苄位或烯丙位亚甲基氧化为羰基化合物。 常用氧化剂----PDC 四十六、Koser试剂 Koser试剂:羟基(对甲苯磺酰氧基)碘苯, Hydroxy(tosyloxy)iodobenzene (HTIB) HTIB是有碘苯很容易制备的试剂,可以对各种化合物进行OTs化。例如,由酮制备α-对甲苯磺酰氧基酮,对烯进行順式加成得到1,2- 对甲苯磺酰氧基烷烃。 四十七、Etard铬酰氯氧化 利用铬酰氯将芳基或环烷基上的甲基氧化为醛基的反应。以法国化学家 Alexandre Léon Étard(5 January 1852, Alençon – 1 May 1910)的名字命名。 将甲苯氧化为苯甲醛是非常重要的一个应用。此反应通常产率较低,延长反应时间到几天甚至几周可能会得到较好的收率。利用Bredereck试剂 也能实现此转化。 四十八、邻基参与的选择性环氧化反应示例 【汇总类】常见的环氧化反应 四十九、Adler酚氧化反应
高碘酸钠氧化邻烷基羟基苯酚得到 6,6-螺-2,4-环己二烯酮化合物,接着自发通过Diels–Alder加成二聚的反应。此反应也被称为Adler-Singh反应。 五十、琼斯氧化反应(Jones Oxidation)
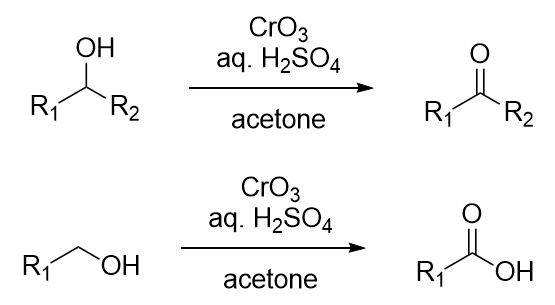
Jones氧化反应(琼斯试剂氧化)是铬酸在丙酮中将一级和二级醇分别氧化为羧酸和酮的反应。Jones试剂(琼斯试剂),由三氧化铬、硫酸与水配成的水溶液。 五十一、Swern氧化反应 利用草酰氯,DMSO和三乙胺将醇氧化为相应的羰基化合物的反应。 五十二、1,2-二醇的氧化制备醛酮 五十三、Konaka镍氧化试剂 过氧化镍被称为Konaka镍氧化试剂,在大极性试剂中其可以将伯醇氧化为羧酸,仲醇氧化为酮。在石油醚或苯等有机溶剂中进行时,过氧化镍则可以将一级醇氧化为相应的羰基化合物,如醛。
五十四、Delepine醛氧化反应
银盐将醛在温和条件下氧化为羧酸的反应。 五十五、 Julia-colonna不对称环氧化反应 五十六、芳香硫醇及相关衍生物氧化合成芳香磺酰氯 五十七、Graham双吖丙啶合成
五十八、常用氧化剂----次氯酸钠 常用氧化剂----间氯过氧苯甲酸 常用氧化剂----过氧苯甲酸 常用氧化剂----DDQ 常用氧化剂----过氧乙酸 常用氧化剂----高锰酸钾 常用氧化剂----四氧化钌 常用氧化剂----臭氧 常用氧化剂----高碘酸钠 常用氧化剂----硝酸铈铵 常用氧化剂----四乙酸铅 常用氧化剂----尿素过氧化氢复合物 常用氧化剂----四吡啶重铬酸合钴(II) 常用氧化剂----DMP 五十九、 【有机反应百科】Minisci环氧化
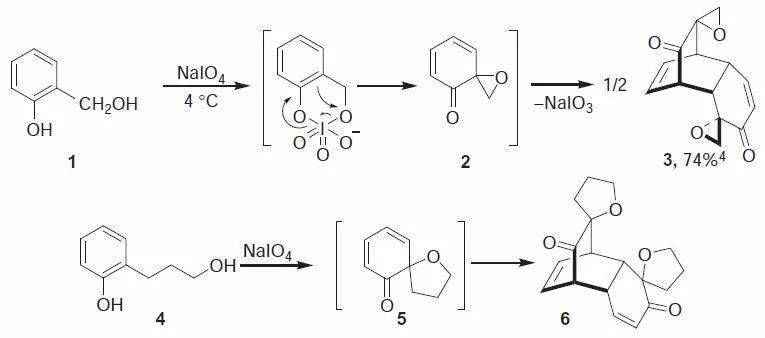
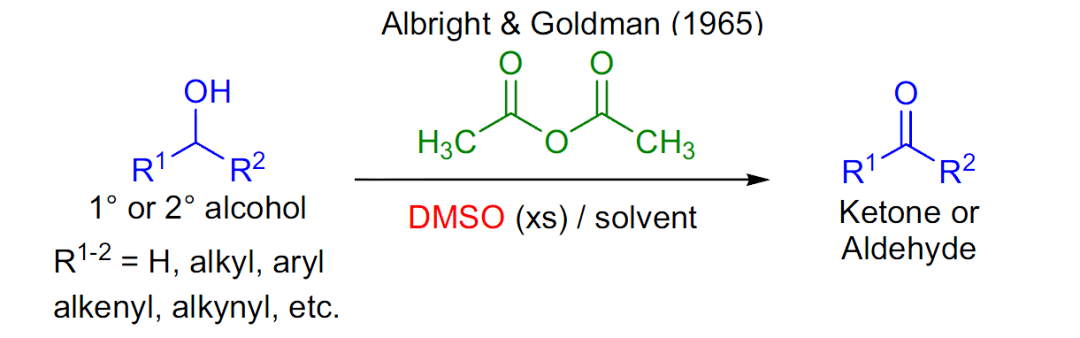
六十、 Achmatowicz反应 糠醇类化合物在Br2、NBS、mCPBA、TBHP-VO(acac)2等氧化条件下重排合成二氢吡喃环的反应。在甲醇中进行电化学氧化也能进行此反应。 六十一、 Albright–Goldman氧化反应
乙酸酐和DMSO作为活化剂的将醇氧化为醛酮的反应。Albright, J. D.和Goldman, L. 在1965年首先系统的介绍了此反应。【 J. Am. Chem. Soc. 1965, 87, 4214】。反应也可在在室温下进行,延长反应时间至12-24小时。此方法不是很好的氧化醇为醛酮的方法,基本可以用 Swern氧化 反应代替,该反应特别对立体位阻较大的醇的氧化效果较好。 六十二、 Minisci反应 亲核碳自由基对质子化的缺电子芳香杂环进行自由基加成生成取代杂环化合物的反应。需要加入氧化剂 氧化自由基加成物,重新芳基化得到产物。 六十三、 苄醚保护羟基脱保护之氧化法 前期介绍了苄醚保护羟基 (点击查看)的上保护的方法,苄醚的脱保护常见的方法主要分为三类:氧化法脱保护,还原法脱保护和路易斯酸碱脱保护。下面先介绍氧化法脱保护。 六十四、 马拉破瑞德乙二醇氧化断裂 Malaprade Glycol Oxidative Cleavage 二醇裂解机理两例 六十五、 由胺制备腈 六十六、 LIEBEN卤仿反应
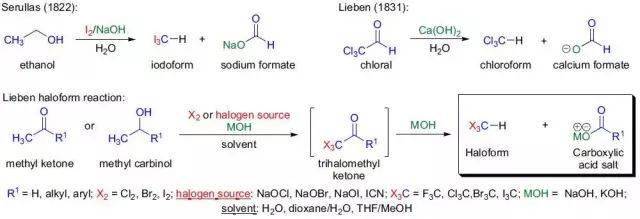
甲基酮或2-位醇和次卤酸盐反应得到卤仿和羧酸的反应被称为Lieben 卤仿反应。返回搜狐,查看更多 |
【本文地址】